

盡管在2021年12月歐盟發(fā)布公告IVDR實施日期延期,但是對于A類產品,,仍必須在2022年5月26日之前以Self-declaration符合(EU)2017/746才可進入歐盟市場,,A類產品歐盟注冊迫在眉睫。
IVDR新法規(guī)增加了很多全新的要求,,包括產品分類,,唯一器械標識(UDI),CE相關認證方(制造商,、歐盟授權代表,、經銷商等)在歐盟注冊要求,性能評估及上市性能跟蹤要求,,上市后市場監(jiān)督要求等,。對于生產商來說,提高了歐盟市場的準入門檻,,并且對其監(jiān)管更加嚴格,,給制造商帶來極大的挑戰(zhàn)。
明德生物緊鑼密鼓地開展了法規(guī)跟蹤與實施工作,,按照IVDR法規(guī)要求,,完善產品性能,完成產品技術文檔及體系升級,,4款產品:Disposable virus sampling tube (一次性病毒采樣管),,Sample release Reagent(樣本釋放劑),Full-Automatic Nucleic acid Extraction and Purification Instrument (全自動核酸提取純化儀)及Nucleic Acid (DNA/RNA) Extraction Kit(核酸提取試劑)已于2022年3月18日通過了歐盟IVDR注冊,。 附注冊確認部分截圖: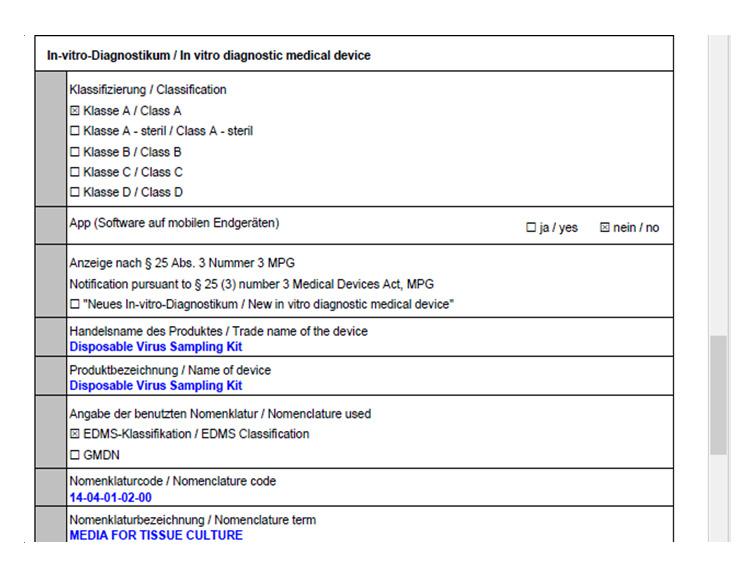
TEL:027-86507708

Copyright © 2024 武漢明德生物科技股份有限公司版權 | 鄂ICP備12000100
互聯(lián)網藥品信息服務資格證書 [(鄂)-非經營性-2016-0005]
 鄂公網安備 42011502000634
鄂公網安備 42011502000634
